中裕新藥昨(9)日舉行新竹生醫園區新建廠房工程上樑典禮,中裕表示,這個台灣生產基地明年將完成,此次上樑是公司發展重要階段,期望能於近期內達成台灣廠商獲得美國FDA核准取得首張蛋白質新藥藥證。
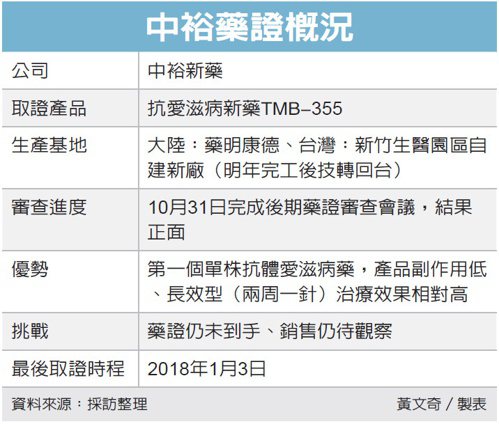
至於是否有可能「失敗」,中裕指出,TMB-355現在已進入審查的最後一關,不至於有「失敗」的問題,最多就是審查延期,今年10月底的後期審查會議已確定審查時程如期,取證機會正面。
中裕對於旗下抗愛滋病新藥TMB-355今年取證「正面樂觀」,目前歐美行銷團隊已就緒,就等藥證到手一個月內即可開賣。若順利取證,單人一年療程定價5萬美元以上,美國市場一年銷售額可望超越10億美元。
中裕當前有優勢也有挑戰,在優勢方面,TMB-355除擁有美國FDA認可的孤兒藥、優先審查等條件外,中裕昨日表示,TMB-355是全球第一個抗愛滋病的單株抗體(蛋白質)新藥,有別於化學藥,對人體的副作用相對較低。再者,TMB-355也是全球第一個抗愛滋病的長效型新藥,相對於當前主流用藥一天要打二針,中裕的產品是二周打一針,業界認為,若上市可望對市場產生一定的破壞式革新。
在挑戰方面,中裕藥證是否100%如期到手,無人能夠保證。中裕表示,以TMB-355的臨床數據來看,可說是「非常好」,對取證是絕對正面;另外對於取證時程,從10月31日的後期審查會議開完後,美國FDA都有可能公告,最晚就是明年1月3日,但一般而言,應該不會拖過耶誕節。